Autores: José Antonio País, José Padilla, Misael Coste, Edgar Pérez, Orlando Acosta. Centro de Ingeniería Mecánica y Diseño Industrial (CIMECDI). FIIIDT.
La Electrolisis
Ante todo, se debe hablar un poco de que es la electrolisis, en que consiste.
“La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes), gracias a la administración de corriente eléctrica” (1)
Hay que explicar unos conceptos para entender lo que es la electrolisis:
- Disociación: en química se refiere a la ruptura de una molécula en átomos o moléculas más sencillas.
- Las sustancias electrolíticas: son aquella que al disolverse en agua pueden conducir la electricidad. Esto se debe a q son sustancias iónicas, es decir forman iones en el agua, y estos son los responsables de conducir la corriente.
- Iones: es una molécula o átomo que presenta carga eléctrica positiva o negativa (si es positiva se le da el nombre de catión y si es lo contrario, negativa se le conoce como anión).
Para que nosotros podamos entender lo que hoy conocemos como electrolisis, hay que darles las gracias a muchos científicos como: William Nicholson, Anthony Carlisle, Hans Christianson Oersted, Nicholson’s Journal, Theodor von Grotthuss, Charles Augustin de Coulomb, entre otros.
Uno de los que tuvo una gran importancia para la electrolisis fue Michael Faraday, ya que contribuyó con 2 leyes para la electrolisis:
- Primera Ley: La cantidad de sustancia depositada o liberada en un electrodo es directamente proporcional a la cantidad de electricidad (carga) que pasa por él.
- Segunda Ley: La cantidad de electricidad que se requiere para depositar o liberar un equivalente químico de un elemento es siempre la misma y es aproximadamente 96500 C (Coulombs o Culombios) (1).
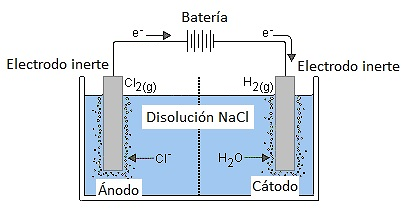
En la imagen 1 vemos las partes necesarias para realizar un proceso electrolítico, en ellas podemos ver que se necesitan por lo mínimo dos electrodos (uno de ellos va a ser el ánodo donde se conecta la parte positiva de la fuente y donde ocurre la oxidación y el otro se conecta la masa de la fuente y es conocido como cátodo y es donde ocurre la reducción), una fuente de corriente continua, un recipiente preferiblemente de plástico o vidrio y una sustancia electrolítica.
En la electrolisis se usa la energía eléctrica para separar los elementos de un compuesto (como se explicó anteriormente). Un electrodo que atrae los cationes hacia él. Y otro electrodo que es positivo y se llama ánodo porque atrae los aniones. La batería se encarga de suministrar electrones al cátodo.
Ahora bien, ya que sabemos un poco de la electrolisis, surgen las siguientes incógnitas: ¿Qué tan importante es?, ¿Dónde se utiliza?, ¿la vida que conocemos sería igual como la conocemos sin la electrolisis?
Analizando las preguntas anteriores podemos decir que si respondemos la segunda pregunta, las demás se responderán solas, así que vamos a responder la segunda ¿Dónde se utiliza?
Aplicación de la electrolisis
Creo que lo primero que viene a la mente es la industria química ¡no!, podemos decir que en un principio fue así, obteniendo hidrogeno, sodio, potasio, magnesio, hidróxido de sodio, ácido clorhídrico, hipoclorito, entre otros elementos.
Uno del más importante es la producción de aluminio por el proceso de Hall-Hérault, según el documento Electroquímica 3 de La Magdalena. Avilés. Asturias (https://fisquiweb.es/Apuntes/Apuntes2Qui/Electroquimica3.pdf), “…el aluminio es uno de los metales más ampliamente usados debido a sus propiedades: baja densidad, elevada conductividad térmica y eléctrica, buenas propiedades mecánicas (que pueden ser mejoradas si se añaden pequeñas cantidades de cobre, magnesio, manganeso o silicio), dúctil y maleable, bajo punto de fusión (fácil reciclado), resistencia a la corrosión (debido a que en contacto con el oxígeno del aire se forma en la superficie una fina película de Al2O3 que aísla al metal protegiéndolo—” y gracias al método de Hall-Hérault, permite obtener aluminio con un grado de pureza superior al 99%.
Otro elemento que se puede obtener por la electrolisis es el hidrogeno, que es muy usado como combustible en la soldadura.
También se utiliza la electrolisis para el recubrimiento de piezas metálicas para protegerlas de la corrosión y este proceso se conoce por electrodeposición, el metal base que se quiere proteger de la corrosión se coloca en el electrodo negativo (cátodo), donde ocurre la reducción y en el electrodo positivo donde ocurre la oxidación (ánodo), se coloca el material que va a recubrir o el electro-depósito, en la tabla 1 se muestra los electrodos más utilizados para la electrodeposición (3)

Esta son unas de las utilidad de la electrolisis para la vida moderna, ya vemos que es muy importante para las industrias, pero también se utiliza en la arqueología ya que según t. España, v. Montiel, m. López-segura, a. ALDAZ de la Universidad de Alicante (2) en sus estudios de limpieza y restauración electroquímica de objetos arqueológicos metálicos, ellos comentan de las ventajas que tiene utilizar procesos electrolíticos para limpiar piezas metálicas arqueológicas, ellos concluyen con lo siguiente:
- Se evita el uso de productos abrasivos que deterioran la superficie.
- Debido a la reducción de los protones, se produce un desprendimiento de hidrógeno que es capaz de limpiar la superficie del objeto (no hay por tanto que limpiar previamente las piezas).
- Se produce un gran ahorro de tiempo en la restauración: por estos métodos, la limpieza de una moneda se realiza en cuestión de horas y no en días según los métodos tradicionales.
- El procedimiento puede automatizarse con facilidad. Pueden llegar a tratarse muchas piezas simultáneamente mediante la utilización de cátodos diseñados a tal efecto.
- El procedimiento es barato y no requiere de manos expertas para ponerlo en práctica ya que la pieza siempre está protegida por la propia corriente, al ser cátodo.(3)
Ellos compararon el proceso de electrolisis con los procesos tradicionales que se usan para limpiar las piezas metálicas.
Se puede afirmar que son importantes e interesantes las diferentes vertientes que tiene la electrolisis desde la disociación de elementos, pasando por el recubrimiento y terminando con la limpieza de piezas, estos tipo de procesos de gran utilidad para el sector industrial, se deben el gran medida a científicos como de Michael Faraday o Charles Agustín de Coulomb, que dedicaron sus años a la investigación de esta importante técnica para la industria metalmecánica.
REFERENCIAS BIBLIOGRÁFICAS
- Armando Ayala Corona, Electrólisis (2015). http://paginas.fisica.uson.mx/armando.ayala/cursos/moderna2/Electrolisis.pdf
- Tomás España, Marcelo López y otros. Universidad de Alicante. (1985). Limpieza y restauración electroquímica de objetos arqueológicos metálicos https://www.researchgate.net/publication/39437750_Limpieza_y_restauracion_electroquimica_de_objetos_arqueologicos_metalicos
- Felipe Díaz del Castillo Rodríguez. PRINCIPIOS DE ELECTRODEPOSICIÓN (2008). http://olimpia.cuautitlan2.unam.mx/pagina_ingenieria/mecanica/mat/mat_mec/m6/principios%20de%20electrolisis.pdf
- Ángeles Méndez. Aplicaciones industriales de la electrólisis (2013): https://quimica.laguia2000.com/metalurgia/aplicaciones-industriales-de-la-electrolisis
- IES La Magdalena. Avilés. Asturias Electroquímica (III) Electrolisis https://fisquiweb.es/Apuntes/Apuntes2Qui/Electroquimica3.pdf
Contacto: japadillamarcano@gmail.com; jantoniop11@gmail.com
