- IMPORTANCIA
El hierro es un metal maleable, de color gris plateado, presenta propiedades magnéticas a temperatura ambiente y a presión atmosférica, su densidad es de 7,86 g/ml y funde a 1535°C. El contenido de hierro en la corteza terrestre es de un 5%, incluso el núcleo de nuestro planeta está constituido principalmente por este elemento [1].
Los minerales de hierro son rocas de los que se puede extraer hierro metálico. Se encuentra en la naturaleza formando óxidos, hidróxidos, carbonatos, silicatos y sulfuros, pero los minerales más utilizados para su transformación en hierro metálico, a través de procesos siderúrgicos son: hematita (Fe2O3), magnetita (Fe3O4), siderita (FeCO3) y limonita (FeO(OH).nH2O) [2].
Casi todo el mineral de hierro se convierte en arrabio para la fabricación de acero, que luego se utiliza en la construcción, el transporte, la infraestructura energética y los electrodomésticos. Para que un mineral pueda ser utilizado en la obtención de hierro, debe reunir dos condiciones: ser abundante y presentar una elevada concentración del elemento [3].
De esta manera es muy importante determinar la proporción de hierro en el yacimiento para poder juzgar si será rentable o no su procesamiento, para la obtención de hierro metálico. Además de esto, es necesario determinar la pureza del producto final, es decir, si la mayor parte es hierro metálico o bien, es una mezcla de este con óxidos férricos y ferrosos, debido a una transformación incompleta en el producto deseado. Estas determinaciones se pueden realizar mediante análisis químico.
Los diferentes minerales de hierro contienen el elemento en estado divalente (ferroso Fe+2) y trivalente (férrico Fe+3), al ser disueltos en ácido concentrado, ambos estados de oxidación coexisten en equilibrio. La cuantificación del elemento se realiza mediante una titulación de oxidación-reducción (redox), en donde se determina el hierro presente en solución, a un determinado estado de oxidación, con una solución valorada de un agente oxidante o reductor [4].
- DETERMINACIÓN DE HIERRO METÁLICO (Fe°)
La determinación de hierro metálico (Fe°) es una reacción de oxido/reducción donde este pasa a hierro ferroso (Fe+2) por acción del cloruro férrico (FeCl3), según la siguiente reacción:
Fe° + 2 Fe+3 → 3Fe+2
El hierro reducido, Fe+2, se titula con una solución de dicromato de potasio usando como indicador difenilaminsulfonato de sodio, la reacción que se lleva produce es la siguiente:
6 Fe+2 + Cr2O7 -2 + 14H+ → 6Fe+3 + 2Cr+3 + 7H2O
El procedimiento que se describirá a continuación puede ser aplicado a minerales de hierro, productos siderúrgicos, productos de calcinación y productos prerreducidos [5].
2.1 Reactivos utilizados
a) Mezcla ácida: a 30 ml de agua destilada se vierten 15 ml de ácido fosfórico concentrado, se enfría en baño de agua y seguido se adicionan 15 ml de ácido sulfúrico concentrado. Se enraza a 100 ml con agua destilada.
b) Solución de FeCl3. 6H2O (250 gr/l): disolver 25 g del reactivo en 60 ml de agua destilada y enrasar a 100 ml.
c) Difenilaminsulfonato de sodio (0.2%): disolver 0,20 g de la sal en 100 ml de agua destilada. Se debe guardar la solución en un envase ámbar.
d) Solución de dicromato de potasio (0.1000 N): disolver 0.4904 g de la sal seca (145 ± 5 °C por 2 horas) con agua destilada y enrasar a 100 ml.
e) Gas inerte: se puede utilizar nitrógeno (N2) o dióxido de carbono (CO2)
2.2 Condiciones de la muestra
a) Tamaño de partícula: menor de 150 micras.
b) Muestra seca (Norma COVENIN 1240)
c) Peso de muestra: para productos siderúrgicos entre 0.5-1.0 g y demás materiales entre 0.2-0.5 g
d) Lavado de muestra: con alcohol o éter etílico.
2.3 Sistema de tratamiento de muestra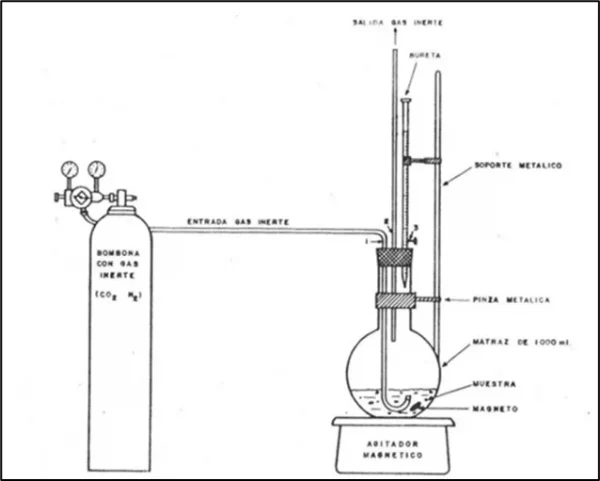 Figura 2. Sistema de tratamiento de muestra para la determinación de hierro metálico [6].
Figura 2. Sistema de tratamiento de muestra para la determinación de hierro metálico [6].
2.4 Procedimiento
a) En un matraz de 500 ml colocar la muestra y 15 ml de agua destilada. Tapar y pasar una corriente de gas inerte. Una vez controlado el flujo de gas adicionar 35 ml de solución de FeCl3.
b) Calentar la solución a 80°C con agitación durante 45 min. Después de cesada la reacción enfriar el matraz utilizando un baño de agua fría.
c) Interrumpir la corriente de gas inerte, retirar el tapón y adicionar 30 ml de mezcla acida sulfo-fosfórica
d) Diluir la solución en el matraz hasta 300 ml, añadir 5 gotas de indicador (Difenilaminsulfonato de sodio) y titular con solución de dicromato de potasio hasta viraje de verde azulado a violeta.
e) Se debe realizar un blanco siguiendo todos los pasos anteriores utilizando agua destilada y la misma cantidad de reactivos.
2.5 Calculo del %Fe°
El porcentaje de hierro metálico se determina, mediante la siguiente formula:
% Fe° = (V – V1) x N x 0.05585 x 100
m x 3
donde:
V : volumen de solución de dicromato consumidos por la muestra, en ml.
V1 : volumen de solución de dicromato consumidos por el blanco, en ml
m : peso de muestra, en g
N : normalidad de la solución de dicromato de potasio, en meq/ml (0,05585 : en g/meq de Fe)
meq : miliequivalentes
- DETERMINACIÓN DE ÓXIDO FERROSO
El contenido de oxido ferroso, presente en minerales de hierro y productos siderúrgicos, puede ser determinado mediante una reacción de oxido/reducción donde el material a ser analizado es disuelto, en una primera etapa, en una solución de ácido clorhídrico bajo atmosfera inerte. Luego se adiciona una mezcla de ácidos sulfúrico y fosfórico, la solución resultante se titula con una solución estandarizada de dicromato de potasio [6][7]. La reacción de oxido/reducción se presenta a continuación:
6 Fe+2 + Cr2O7 -2 + 14H+ → 6Fe+3 + 2Cr+3 + 7H2O
3.1 Reactivos utilizados
a) Ácido Clorhídrico diluido (1:1)
b) Mezcla ácida sulfo-fosfórica: a 30 ml de agua destilada se vierten 15 ml de ácido fosfórico concentrado, se enfría en baño de agua y seguido se adicionan 15 ml de ácido sulfúrico concentrado. Se enraza a 100 ml con agua destilada.
c) Difenilaminsulfonato de sodio (0.2%): 0.20 gr de la sal se disuelven en 100 ml de agua destilada. Se debe guardar la solución en envase ámbar.
d) Dicromato de potasio (0.0100N): 0.4904 gr de la sal seca (145 ± 5 °C por 2 horas) se disuelven en agua destilada y se enraza a 1 L.
e) Gas inerte: se puede utilizar nitrógeno (N2) o dióxido de carbono (CO2).
3.2 Condiciones de la muestra
a) Tamaño de partícula: menor de 150 micras
b) Muestra seca, según Norma COVENIN 1240
c) Peso de muestra: entre 0,5000 – 1,0000 g
3.3 Procedimiento
a) En un matraz de 500 ml, provisto de un tapón bihoradado, se coloca la muestra a ser tratada y a continuación se expulsa el aire del interior del matraz mediante una corriente de gas inerte (N2 o CO2).
b) Sin Interrumpir la corriente de gas, adicionar 50 ml de ácido clorhídrico diluido (1:1) y calentar a temperatura por debajo de 80 °C durante 45 min. Enfriar el matraz utilizando un baño de agua fría. El tratamiento de muestra se realiza mediante el sistema presentado en la figura 2.
c) Interrumpir la corriente de gas, retirar el tapón y adicionar 30 ml de mezcla acida sulfo-fosfórica.
d) Diluir la solución hasta 300 ml y adicionar de 5 a 8 gotas de indicador (Difenilaminsulfonato de sodio). Titular con solución de dicromato de potasio hasta viraje de verde azulado a violeta.
3.4 Cálculo del % de FeO
El porcentaje de hierro metálico se determina, mediante la siguiente formula:
% FeO = V x N x 0.07185 x 100
m
donde:
V : volumen de solución de dicromato consumidos por la muestran, en ml
N : normalidad de la solución de dicromato de potasio, en meq/ml
m : peso de muestra, en g (0,07185: en g/meq de FeO)
REFERENCIAS BIBLIOGRÁFICAS
1.- Wikipedia (2024), HIERRO. En: https://es.wikipedia.org/wiki/Hierro (consultada el 28/102014)
2.-Wikipedia (2024), https://es.wikipedia.org/wiki/Siderurgia (consultada el 28/102014)
3.- Manuel Torres Búa (2014). MATERIALES DE USO TÉCNICO. Junta de Galicia, España.
4.- Rolando Oyola Martínez (2013). TITULACIÓN REDOX: DETERMINACIÓN DE HIERRO EN UN MINERAL. Universidad de Puerto Rico – Humacao, Puerto Rico.
5.- Norma COVENIN 1245:1997. MINERALES DE HIERRO Y PRODUCTOS SIDERURGICOS. DETERMINACION DEL HIERRO METALICO. METODO DEL CLORURO FERRICO
6.- Norma COVENIN 1242:1978. MINERALES DE HIERRO. METODO DE TITULACION CON DICROMATO DE POTASIO PARA LA DETERMINACION DEL OXIDO FERROSO
7- Norma COVENIN 1242:2001. MINERALES DE HIERRO Y PRODUCTOS SIDERURGICOS. DETERMINACION DEL OXIDO FERROSO. METODO DE TITULACION CON DICROMATO DE POTASIO.
Unidad de Química y Ambiente,
Centro de Tecnología de los Materiales (CTM)
![]()










