1. Introducción
La celulosa es el polímero orgánico más abundante de la Tierra, constituye el componente estructural principal de las paredes celulares de las plantas (Figura 1). Químicamente, es un polisacárido lineal compuesto por unidades de D-glucosa unidas mediante enlaces β(1→4)-glucosidicos.
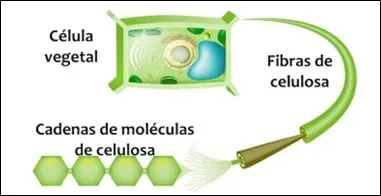
Figura 1. Cadenas de moléculas de celulosa
(Fuente: https://concepto.de/celulosa/)
A pesar de su abundancia y potencial como recurso renovable para bioplásticos, fibras y biocombustibles, su utilización industrial se ve limitada por una característica fundamental: su extrema resistencia a la disolución en agua y en la mayoría de los solventes orgánicos convencionales. Esta «recalcitrancia» no es accidental, sino el resultado de una arquitectura molecular diseñada por la naturaleza para proporcionar rigidez y protección mecánica a los organismos vegetales.
2. La arquitectura química: ¿Por qué es tan difícil de disolver?
La dificultad para disolver la celulosa radica en su compleja red de enlaces y su organización supramolecular. A diferencia de otros polímeros, la celulosa no es simplemente una cadena de azúcares; es un sistema altamente ordenado.
La estructura de la celulosa se mantiene unida por cuatro tipos de interacciones críticas o fuerzas intermoleculares:
- Enlaces covalentes β (1→4)-glucosidicos: Estos conectan las unidades de glucosa formando cadenas lineales rígidas.
- Enlaces de hidrógeno intramoleculares: Se forman entre los grupos hidroxilo (-OH) de la misma cadena. Estos enlaces estabilizan la conformación lineal y confieren rigidez a la cadena individual.
- Enlaces de hidrógeno intermoleculares: Estos son los verdaderos responsables de la insolubilidad. Conectan cadenas adyacentes, empaquetándolas en láminas densas.
- Fuerzas de Van der Waals y apilamiento hidrofóbico: Aunque a menudo se ignora, la cara axial de los anillos de glucosa es relativamente hidrofóbica. Las láminas de celulosa se apilan unas sobre otras mediante interacciones de dispersión, creando una estructura tridimensional altamente cristalina
2. Estructura supramolecular de la celulosa
La celulosa (Figura 2) natural existe en un estado semisólido donde coexisten regiones de alto orden (cristalinas) y regiones de bajo orden (amorfas). Si un solvente penetra a la celulosa, no solo debe recorrer las zonas laxas, sino también debe romper la red de hidrógeno en el núcleo cristalino, lo cual requiere una energía de activación considerable.
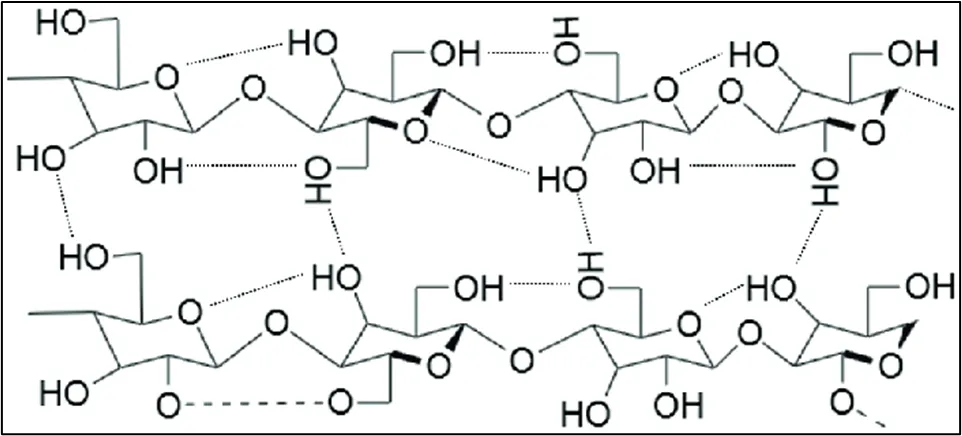
Figura 2. Estructura de la celulosa y enlaces inter e intra cadenas.
(Fuente: https://doi.org/10.47187/perf.v1i28.179)
En general, en la celulosa se pueden encontrar cuatro regiones o niveles:
- Nivel 1: Molécula de glucosa (C₆H₁₂O₆)
- Nivel 2: Cadena polimérica (Grado de polimerización de 1,000 a 15,000).
- Nivel 3: Microfibrilla (Agregación de cadenas mediante puentes de hidrógeno).
- Nivel 4: Fibra de celulosa (Estructura macroscópica).
3. Sistemas de disolución: Rompiendo la red
Para disolver la celulosa, el sistema solvente debe ser capaz de competir con los enlaces de hidrógeno propios del polímero. Los sistemas se dividen generalmente en tres categorías:
3.1 Solventes no derivativizantes (Disolución física)
Estos disuelven el polímero sin alterar su estructura química. Algunos son:
- N-Metilmorfolina-N-óxido (NMMO): Utilizado en el proceso Lyocell. Requiere temperaturas de 90°C a 120°C. Es eficiente, pero puede causar degradación térmica de la celulosa si no se controla.
- Líquidos Iónicos (ILs): Considerados «solventes verdes». Son sales fundidas a baja temperatura y altamente efectivas porque el anión (generalmente un haluro o acetato) es un potente aceptor de enlaces de hidrógeno que «secuestra» los -OH de la celulosa.
Existen otros ILs, denominadossolventes eutécticos profundos que son mezclas ecológicas, no tóxicas y económicas que disuelven la celulosa rompiendo sus enlaces de hidrógeno mediante la interacción de un aceptor de enlaces de hidrógeno y un donante, destacando combinaciones como cloruro de colina con urea, ácidos carboxílicos o polioles, a menudo con mayor eficiencia y sostenibilidad que los líquidos iónicos tradicionales.
- LiCl/DMAc (Cloruro de Litio/Dimetilacetamida): Se le conoce como el estándar de oro en laboratorios para análisis. El complejo de litio (Li⁺) interactúa con el oxígeno del carbonilo de la DMAc, liberando iones cloruro libres que rompen los puentes de hidrógeno de la celulosa.
3.2 Solventes derivativizantes (Disolución química)
Implican la formación de un intermediario químico temporal. Por ejemplo, en el proceso denominado Viscosa la celulosa se trata con hidróxido de sodio (NaOH) y disulfuro de carbono (CS₂) para formar xantato de celulosa, que es soluble en álcali. Luego se regenera en un baño ácido.
3.3 Sistemas alcalinos (Álcali/Urea)
Es un método de reciente diseño y sostenible, que utiliza NaOH al 7% y urea al 12% en agua. En este proceso el parámetro crítico es la temperatura: la disolución solo ocurre cerca de los -12°C.
La urea actúa impidiendo la reagregación de las cadenas de celulosa una vez que el hidróxido las ha separado.
4. Parámetros críticos y variables de proceso
La disolución exitosa de la celulosa depende de un equilibrio termodinámico delicado, donde se deben considerar los aspectos considerados en la Tabla 1.
Tabla 1. Parámetros que influyen en la disolución de la celulosa
| Parámetro | Influencia en la Disolución |
| Temperatura | Varía según el solvente: sistemas como NMMO requieren calor para fundir la red, mientras que otros (Álcali/Urea) necesitan frío extremo para estabilizar el complejo soluble. |
| Concentración | La viscosidad aumenta de forma exponencial. Superar el 10-15% suele generar soluciones extremadamente difíciles de procesar o manejar. |
| Grado de Polimerización | A mayor longitud de las cadenas, mayor es la dificultad de disolución debido al incremento de interacciones intermoleculares por cada molécula. |
| Activación Previa | Los tratamientos mecánicos (molienda) o químicos (hinchamiento) aumentan el área superficial, facilitando que el solvente penetre la estructura. |
5. Conclusiones
Disolver la celulosa sigue siendo uno de los mayores retos de la química de polímeros naturales. Su estructura no es solo una secuencia de monómeros, sino un «andamio» molecular fortificado por una red cooperativa de enlaces de hidrógeno y fuerzas hidrofóbicas.
Mientras que los métodos tradicionales como el proceso viscoso son efectivos pero contaminantes, el futuro de la disolución de celulosa se orienta hacia los Líquidos Iónicos y los Solventes Eutécticos Profundos, que ofrecen rutas más limpias y eficientes para transformar la biomasa en materiales avanzados de alto valor añadido.
La comprensión de los parámetros de temperatura y la especificidad de los enlaces involucrados es la llave para desbloquear el potencial infinito del biopolímero. Celulosa.
6. Bibliografía
1) Shchipunov, Y., & Postnova, I. (2018). «Cellulose Mineralization as a Route for Novel Functional Materials» (Mineralización de celulosa como vía para nuevos materiales funcionales). En: https://doi.org/10.1002/adfm.201705042Digital Object Identifier (DOI)
2) Naiya, T. K., Bhattacharya, A. K., & Das, S. K. (2009). «Adsorptive Removal of Cd (II) Ions from Aqueous Solutions by Rice Husk Ash» (Eliminación por adsorción de iones Cd (II) de soluciones acuosas mediante ceniza de cascarilla de arroz). En: https://doi.org/10.1002/ep.10346
3) Manzanilla, J., & Pieters, A. (2020). «Biosorción: Cascarilla de arroz para la remoción de metales pesados».
4) Alsoy Altinkaya S (2024). “A perspective on cellulose dissolution with deep eutectic solvents” (Una perspectiva sobre la disolución de celulosa con disolventes eutécticos profundos). Front. Membr. Sci. Technol. 3:1382054. En: https://www.frontiersin.org/journals/membrane-science-and-technology/articles/10.3389/frmst.2024.1382054/full






